Геномна динамика и стабилност – Епигенетика
Научните интереси са в областта на епигенетичната регулация на генната експресия. Изследванията се извършват в следните направления:
- Изучаване на епигенетичните механизми в хода на растежа и развитието на еукариотните организми – процесите на диференциация, де ново метилиране на генома, геномен импринтинг и др.;
- Изследване на епигенетични промени, и в частност промени в метилирането на ДНК, в следствие на ежедневно използвани вещества като кофеин, никотин, алкохол и др., вещества, използвани в лечебните практики като хормони, терапевтици и др.; както и психичен стрес в следствие от травмиращи житейски събития;
- Изучаване на профила на метилиране в промоторните участъци на таргетни гени, както и изследване на промени в генната експресия при болестни състояния при човека, в това число зависимости към психоактивни вещества и рак. Изследванията се извършват при животински моделни системи и хора, под регулацията на местна етична комисия.
Епигенетичните изменения са „промени в генната функция, които са унаследими и които не са свързани с промяна в последователността на ДНК“ (Wu и Morris, 2001). Това са модификации в ДНК или хистоновите протеини, които модулират генната експресия, като предизвикват промени в структурата на хроматина и така повлияват достъпността до гените (Фиг.1). Могат да бъдат разграничени три основни типа епигенетични регулаторни механизми: метилиране на ДНК, хистонови модификации и некодиращи РНК.
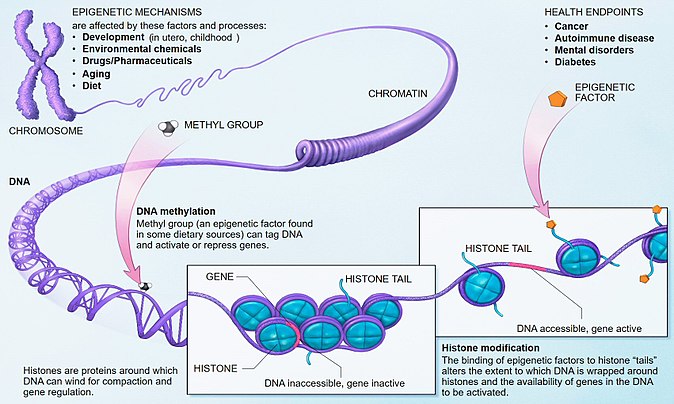
Фиг. 1. Епигенетични изменения и динамика на хроматина.
Изследване на епигентични промени, индуцирани от външни за генома фактори
Изследване на влияние на етaнола върху ембрионалното развитие, експресията и метилационния статус на импринтиран локус Igf2/H19 при Mus musculus
Епигентичната регулация на ДНК е динамичен процес, който позволява информацията закодирана в ДНК да се реализира в зависимост от нуждите на организма и променящaта се среда. Различни фактори от околната среда могат да променят епигенетичните механизми, включително вещества, ежедневно използвани в нашето общество, като никотин, кофеин, алкохол, лекарствени медикаменти и др. Етанолът е класически тератоген и употребата му по време на бременност може да причини широка гама от аномалии в развитието. Механизмите, стоящи в основата на алкохолната тератогенност, все още не са напълно изяснени.
Целта на настоящата разработка е да изследва връзката между етанол – индуцираната промяна в растежа на бластоцисти, ембриони и плаценти и нивото на експресия и метилацонен статус на импринтиран локус Igf2/H19 след въздействие с етанол in vitro и in vivo по време на предимплантационния период на бременността при мишки. Резултатите показаха, че етанолът действа и активиращо и инхибиращо на развитието на бластоцисти в среда in vitro в зависимост от дозите. Приложен in vivo, етанолът проявява инхибиторен, доза-зависим ефект върху нормалния растеж и развитие на ембрионите и техните плаценти (Фиг. 2). Повишава значително нивата на ембрионална резорбция в третираните групи и води до тератогенни ефекти (Фиг. 2). Приложен в условия in vivo и in vitro в предимплантационния период, променя нивата на експресия на Igf2/Н19 локус (Фиг. 3). Въздействието с доза от 5.8 г/кг етанол води до промяна в нивата на експресия на ДНК метилтрансферази Dnmt1, Dnmt3b и Dnmt3а (Фиг. 4), както и до промени в нивата на метилиране на DMRs на Igf2/Н19 локус (Фиг. 5). При ембрионите етанолът повишава нивата на метилиране в DMRH19, а при плацентите намалява нивата на метилиране на DMR0 и DMRH19. Намалените нива на метилиране на DMR0 на Igf2/Н19 локус обуславят алкохол-индуцирано намаление в теглото на плацентите, последното имащо медиаторната роля върху теглото на ембриона (Фиг. 6). Получените резултати показват, че епигенетичният статус и функционалността на импринтираните гени са много чувствителни към въздействието на етанола, а периода на имплантация е силно уязвим и податлив на влиянието на тератогенни фактори.
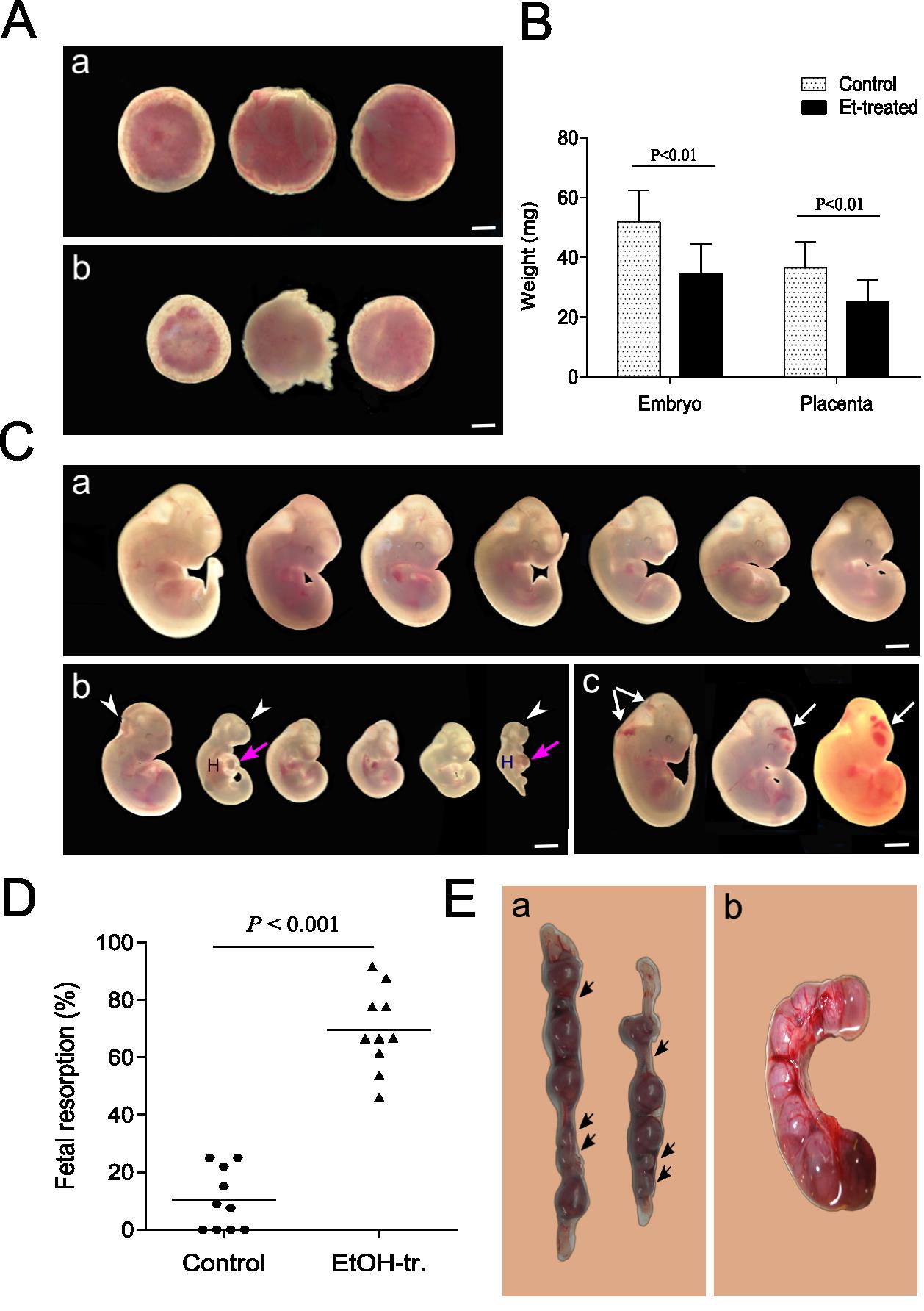
Фиг. 2. Аберантен растеж и развитие на ембриони и плаценти и повишена ембрионална резорбция в следствие въздействието на етанол. Бременни мишки са третирани с 5.8 г/кг алкохол на 4 ден от бременността. Анализите са извършени на 12 ден. (A) Нормален вид на плаценти (а) и плаценти след третиране с 5,8 г/кг етанол (b); (B) Средно ембрионално и плацентно тегло при контролни, нетретирана мишка и след третиране с 5,8 г/кг етанол; (C) Нормален вид на ембриони (a), ембриони след третиране с 5,8 г/кг етанол – с по-ниско тегло и нарушения в развитието (b), ембриони с вътрешни кръвоизливи (бели стрелки) (с); (D) Фетална резорбция; (E) Снимки на двата рога на матката на мишка, третирана с 5,8 г/кг етанол (а) и матка от контролна, нетретирана мишка (b) на 12 ден от бременността. Черните стрелки показват местата на ембрионална резорбция.
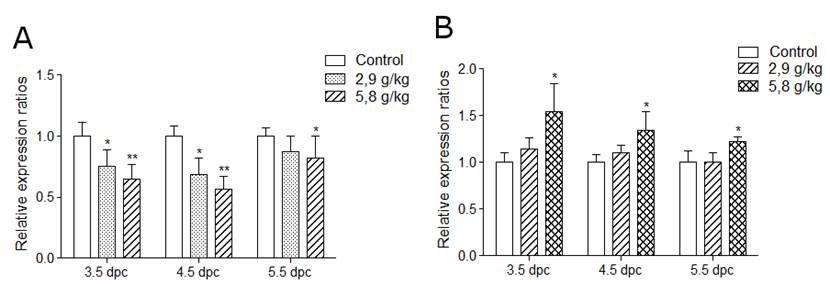
Фиг. 3. Ефект от действието на 2,9 и 5,8 г/кг етанол при ембриони (A) и плаценти (B) след in vivo третиране през 3.5, 4.5 и 5.5 ден след оплождане. Промените в експресията на H19 са изследвани на 12 ден. Данните са представени като средно ± SEM, * p <0,05, ** p <0,01.
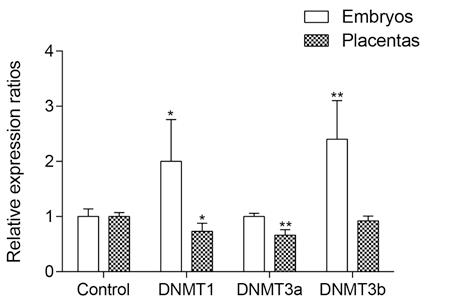
Фиг. 4. Ефект на 5,8 г/кг етанол върху експресията на метилтрансферази DNMT1, DNMT3a и DNMT3b след третиране през 4 ден от бременността. Промените в нивата на експресия са изследвани на 12 ден. Данните са представени като средно ± SEM, * p <0,05, ** p <0,01.
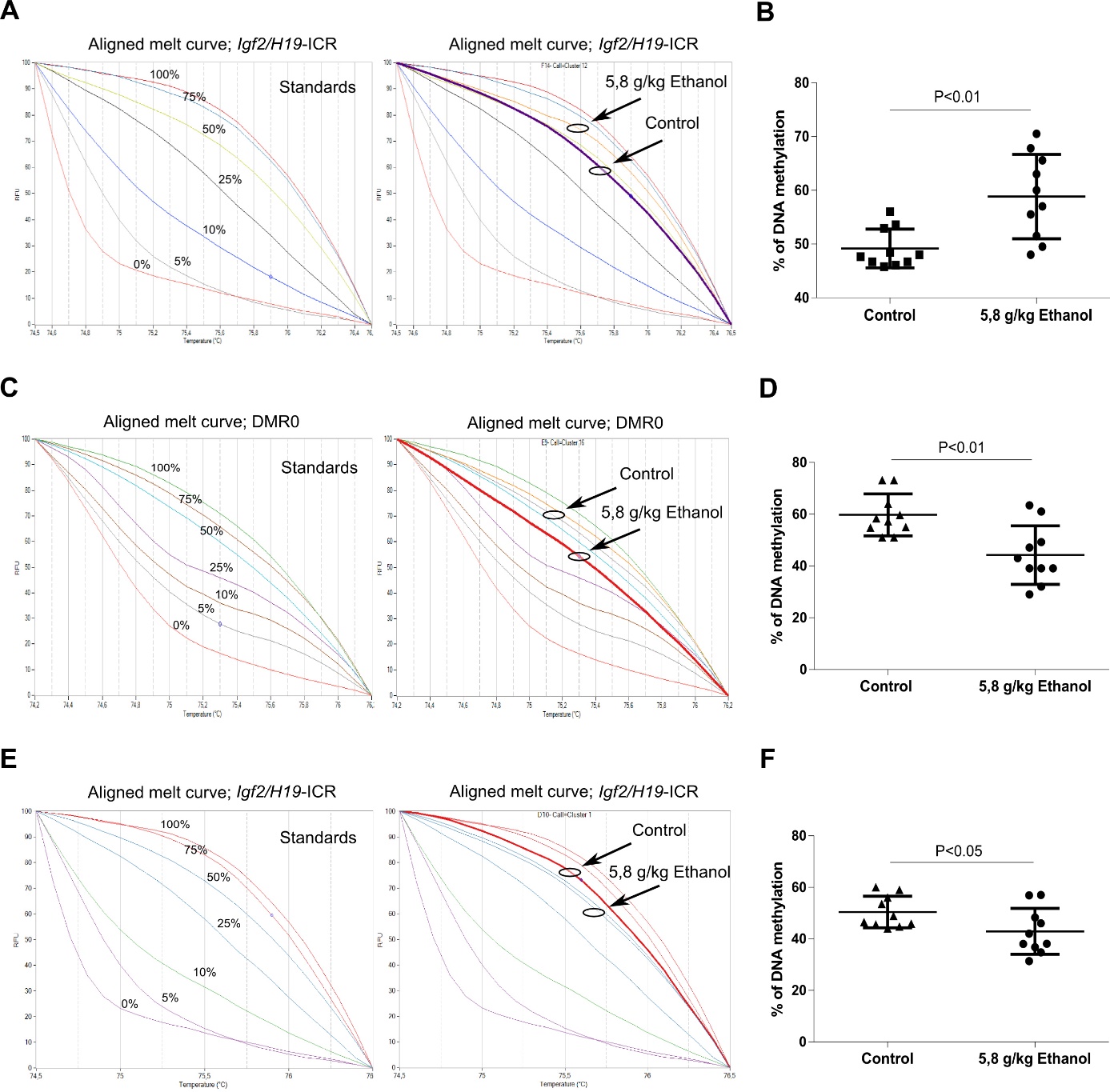
Фиг. 5. Нормализирани данни от MS-HRM анализ на нивото на метилиране на Igf2/H19-ICR и DMR0 в ембриони и плаценти. MS-HRM е използван за определяне на промяната в метилирането на ДНК след третиране с алкохол на базата на секвенционно-зависими профили на топене на ампликоните. Комбинация от напълно метилирана и неметилирана ДНК в различен процент дава различни метилирани и неметилирани криви на топене в диапазон от 0-100% (100%, 75%, 50%, 25%, 10%, 5% и 0% метилиран), които се използват за стандарти. Метилационен стандарт и стандарт с включени криви на топене на третирани с етанол и нетретирани контроли са представени за Igf2/H19-ICR в ембриони (A), DMR0 в плаценти (C), Igf2/H19-ICR в плаценти (E); Графики, показващи средното ниво на метилиране (в проценти) на Igf2/H19-ICR в ембриони (В), DMR0 в плаценти (D), Igf2/H19-ICR в плаценти (F) за отделни проби, включително обработени с етанол и контроли, анализирани с MS-HRM (two-tailed t-test).
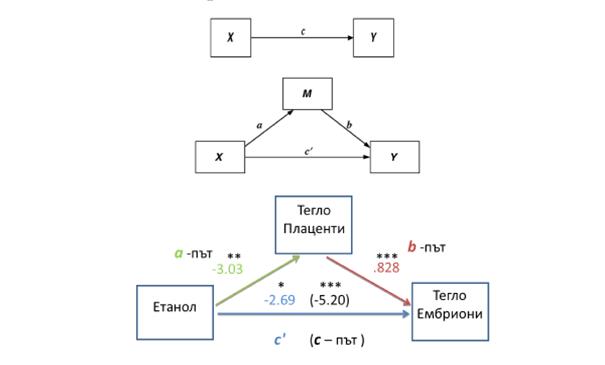
Фиг. 6. Схематично представяне на модел на медиация. Приложени са множествен регресионен анализ и bootstrap алгоритъм на пакета PROCESS и IBM SPSS Statistics 21, за да се оцени всеки компонент на предложения модел за медиация. Резултатите от анализа потвърждават медиаторната роля на теглото на плацентата при въздействие на етанола върху ембрионалното тегло (РМ = .482, СI = -5.73 до -1.02).
Епигенетични изменения в болестния процес при човека
Епигенетични промени се откриват при много комплексни заболявания, включително астма, затлъстяване, сърдечно-съдови заболявания, невродегенеративни нарушения, зависимости и рак, и могат да обяснят някои явления, свързани с вариабилността и клиничната хетерогенност на болестите, които не биха могли да бъдат обяснени изцяло с генетични вариации и промени.
Зависимост към психоактивни вещества (ПАВ)
По данни на Световната Здравна Организация около 2 милиарда души по света консумират или злоупотребяват с алкохол, а по отношение на наркотичните вещества, проблемно употребяващи са около 0.6% от възрастното население. Зависимостите към ПАВ са компонент на повече от 200 болестни състояния и се свързват със сериозни последици върху физическото и психично здраве както на самите злоупотребяващи, така и с вреди върху благосъстоянието на хората от тяхното обкръжение.
Основна цел на изследванията е да се извърши комплексен анализ на някои психо-социални и епигенетични параметри при лица, употребяващи психоактивни вещества, в това число да се извърши скрининг за травматични събития и анализ на качеството на живот, да се проучи нивото на експресия на подбрани таргетни гени и да се извърши анализ на нивото на метилиране на ДНК, както и да се потърсят статистически значими корелации между изследваните параметри.
В изследването са включени три групи лица: 1) в програми за лечение с опиеви агонисти; 2) в програми за детоксикация и психосоциална рехабилитация и 3) клинично здрави контроли. Изследванията се провеждат по следната схема (Фиг.7):
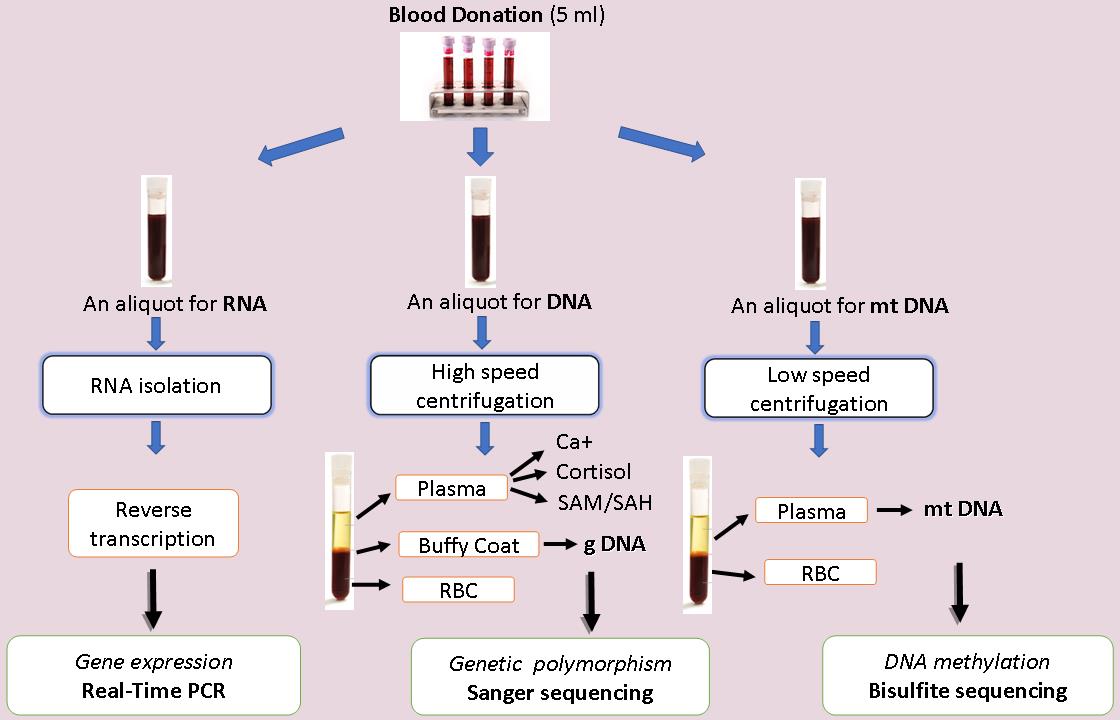
Фиг. 7. Схема на изследвания.
За изследване степента на генна експресия се използва количествена полимеразна верижна реакция след обратна транскрипция (qRT-PCR). На анализ се подлагат следните групи таргетни гени (Фиг. 8):
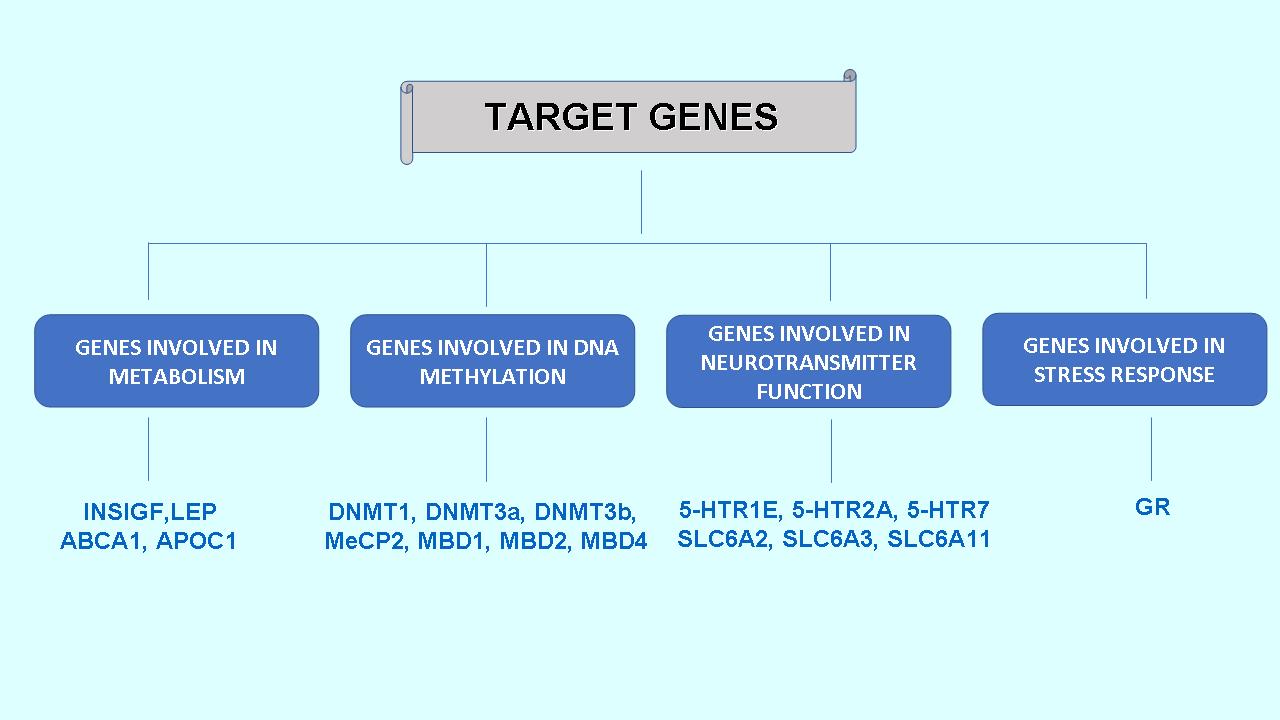
Фиг. 8. Анализирани гени.
